
导语
今天给同学们分享一篇实验文章“Phenotypic diversity of T cells in human primary and metastatic brain tumors revealed by multiomic interrogation”,这篇文章发表在Nat Cancer期刊上,影响因子为22.7。

结果解读:
单细胞RNA测序在携带脑转移瘤的个体中鉴定出pTRT细胞为了评估脑癌(特别是胶质瘤和脑转移瘤)患者中T细胞的表型和功能异质性程度,作者使用了一个综合分析流程 27 ,在单细胞和群体水平上对RNA和蛋白质表达进行了分析(扩展数据图1a)。作者首先通过单细胞RNA测序(scRNA-seq)分析了6例脑转移瘤患者和3例胶质瘤患者的肿瘤浸润淋巴细胞(TILs)和匹配的循环T细胞(补充表1a和扩展数据图1b)。总共分析了55,000个T细胞的统一流形逼近和投影(UMAP)显示TILs和循环T细胞之间存在显著的转录差异(图1a),以及CD4 + 和CD8 + T细胞之间的差异(图1b)。作者鉴定出17个不同的聚类(图1c):七个CD8 + T细胞聚类(C1、C2、C3、C6、C7、C14和C16)和八个CD4 + T细胞聚类(C0、C4、C5、C8、C9、C10、C11和C13),其中C4代表调节性T(T reg )细胞(图1c和补充表1b)。C12和C15包含了CD4 + 和CD8 + T细胞。冷冻保存并未改变T细胞亚群的组成和表型(扩展数据图1c-e),与先前的研究一致 28 。

为了扩大作者的分析范围,超过了scRNA-seq分析中的9个个体,作者接下来对更大的队列进行了分析,包括来自54名脑癌患者和12名健康供体(HDs)的TILs和匹配的血液T细胞,使用人群总体RNA-seq(称为“总体RNA-seq队列”;附表1a和扩展数据图2a)。主成分分析显示TILs和循环T细胞之间的最大差异,而来自脑癌患者或HDs的血液中的T细胞聚集在一起(图2a,顶部,和附表2a)。CD4和CD8 T细胞群体在血液和肿瘤样本中分离(图2a,底部)。使用免疫学特征基因集的分子签名数据库(MSigDB)C7集合,血液T细胞和TILs之间的基因集富集分析(GSEA)显示TILs中CD4和CD8激活和分化基因集富集程度最高,而血液样本中的基因集富集了原始T细胞(图2b,扩展数据图2b和附表2b)。为了确认这些发现,作者使用流式细胞术(扩展数据图2c)评估了不同CD45亚型的表达。与HD和匹配的血液T细胞相比,TILs中CD45RO的比例为90%以上(图2c)。综上所述,这些数据表明脑TILs中存在一种保守的广泛激活和分化程序,似乎与潜在疾病无关。


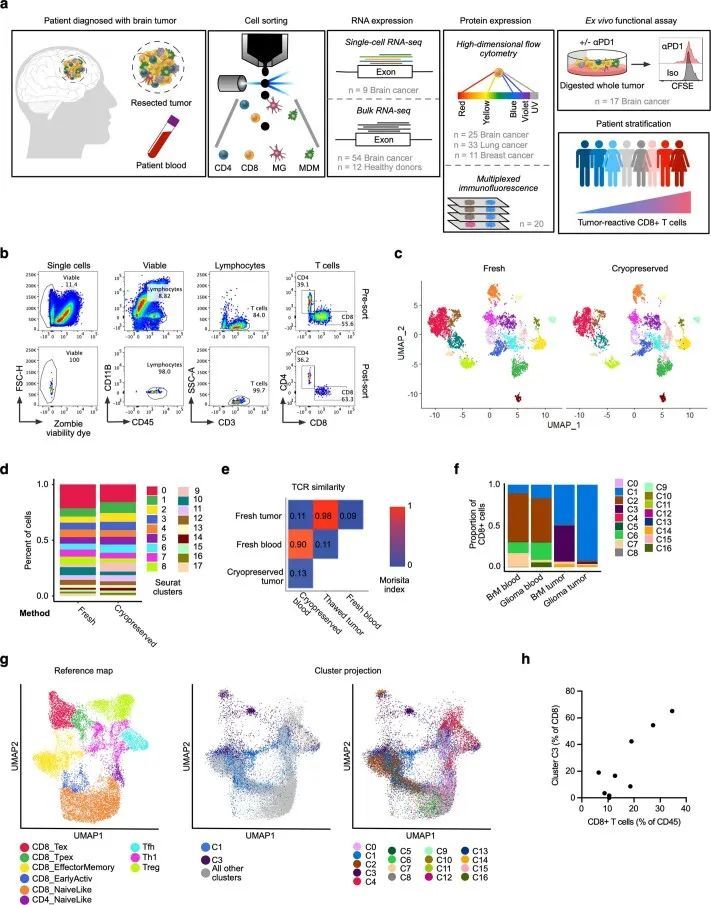
为了验证转录组基于的发现,作者使用了一种独立的方法和独立的队列,接下来通过流式细胞术(FCM)分析了25个脑肿瘤样本(其中3/25个样本也进行了RNA-seq分析)。作者使用CD39作为潜在肿瘤反应性CD8 T细胞的标记物,这在不同类型的癌症中已经被提出,包括非小细胞肺癌(NSCLC)、头颈部鳞状细胞癌、结直肠癌和黑色素瘤(图3a)。细胞进一步被筛选为CCR7,以消除潜在的旁观者幼稚和记忆细胞的污染(图3b)。在BrM和胶质瘤患者的血液中,CD8 CD39 CCR7细胞几乎无法检测到,而在TILs中,作者发现BrM中的比例明显高于胶质瘤(图3b)。与转录组分析类似,这种差异是由BrM中的一部分个体(6/13)驱动的,这些个体中CD39 CCR7 TILs的丰度较高(占所有CD8 T细胞的30%以上)。作者观察到显著的相关性(R = 0.9285,P < 0.002)在FCM检测到的CD39 + CCR7 low TILs的比例与scRNA-seq数据中C3的丰度之间存在相关性(扩展数据图图3a)。在显示CD39 + CCR7 low TILs高积累的个体样本中,作者比较了CD39 + CCR7 low 细胞与CD39 – CCR7 low 细胞上与新抗原反应性T细胞相关的四种分子的表达(图图3c)。CD39 + CCR7 low 细胞相对于其CD39 – 对应物表达了CD103(由ITGAE编码)、CXCL13、PD1(由PDCD1编码)和TIM3(由HAVCR2编码),表明CD39 + CCR7 low 群体确实包含pTRT细胞(图图3d)。
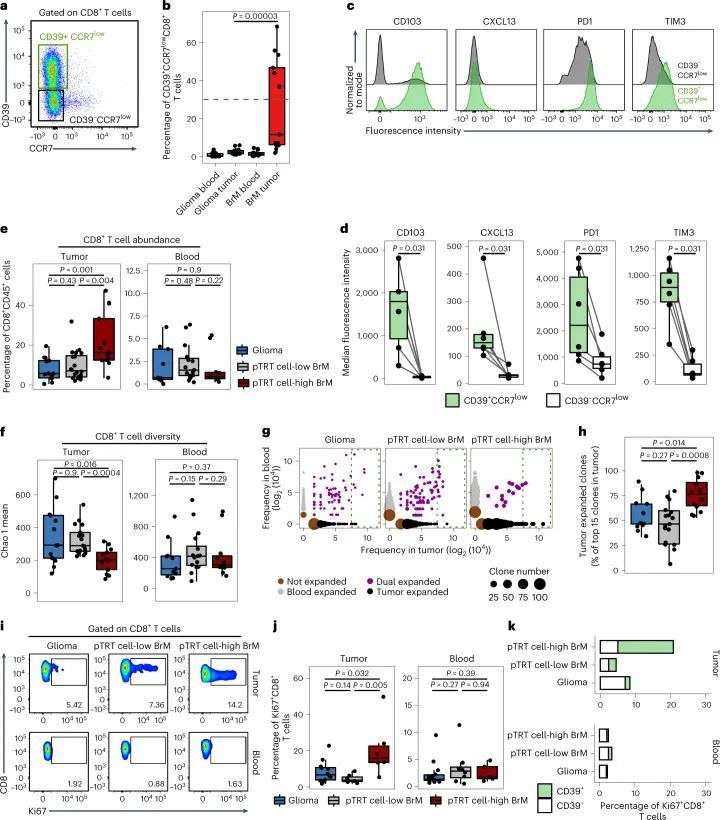
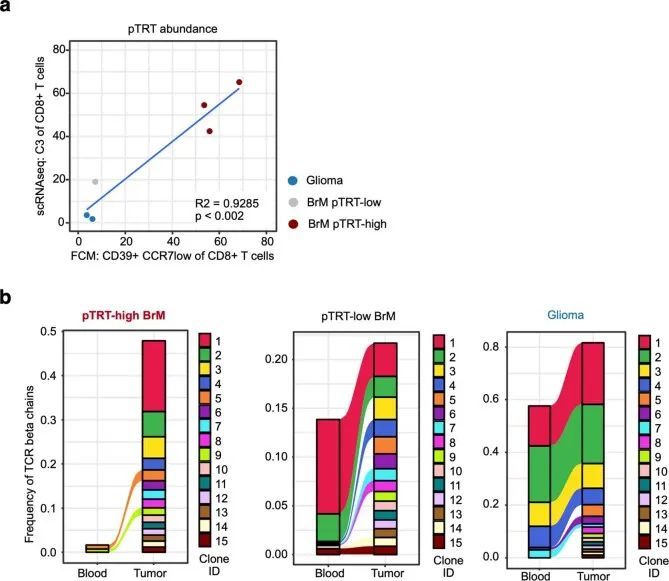
作者接下来查询了T细胞,尤其是pTRT细胞在脑肿瘤中的空间组织。作者对20名患有脑癌的个体的组织切片进行了多重免疫荧光染色(扩展数据图4a)。由于CXCL13(分泌蛋白)和CD39(在血管上的表达水平高于T细胞),不适合用于免疫荧光染色,作者使用CD45 + CD3 + CD8 + T细胞上CD103和PD1的共表达作为潜在肿瘤特异性的指标(扩展数据图4b)。根据scRNA-seq确定的C3的频率、通过批量RNA-seq分析的CD8 + T细胞中C3特异基因的富集程度,或者通过FCM检测到的CD39 + CCR7 low CD8 + T细胞的丰度,将脑转移瘤(BrM)的个体分为pTRT细胞高或pTRT细胞低两组(扩展数据图4c)。通过不同方法进行的分组在使用多种技术分析的样本中是相同的(扩展数据图4d)。CD103 + PD1 + CD8 + 肿瘤浸润淋巴细胞(TILs)在pTRT细胞高的脑转移瘤中比pTRT细胞低的脑转移瘤或胶质瘤中更丰富(图4a,b)。此外,作者通过IF观察到pTRT细胞高表达的BrM中CD8 TIL总浸润较高(扩展数据图4e),这与图3e中的FCM分析结果相一致。


作者接下来调查了高pTRT细胞丰度是否与不同的肿瘤微环境有关,特别是与髓系细胞有关,已经有研究表明髓系细胞在肾脏、前列腺、膀胱和卵巢癌中调节肿瘤特异性T细胞的功能。对25个样本中的>4 × 10个细胞进行空间成像分析发现,在pTRT细胞高的脑转移瘤中,较大比例的CD8 TILs与肿瘤相关巨噬细胞(TAMs)靠近(20μm),其中包括驻留的小胶质细胞(MG;鉴定为CD45 CD68和/或P2RY12 CD49D)和招募的单核细胞源性巨噬细胞(MDMs;鉴定为CD45 CD68和/或P2RY12 CD49D),相比于胶质瘤或pTRT细胞低的脑转移瘤,这可能导致潜在的直接细胞间相互作用。这一观察结果可能部分受到pTRT细胞高的脑转移瘤中总CD8 TILs比例较高的影响。因此,作者接下来分析了CD8 TILs与其最近的TAMs之间的距离。作者发现CD103 + PD1 + CD8 + TILs与最近的MG之间的距离显著较近,尽管程度适度,与最近的MDM之间的距离与其他所有CD8 + TILs相同(图(图5b5b和扩展数据图图5)。这些结果表明,pTRT细胞和非pTRT细胞与TAMs进行沟通的可能性相似。

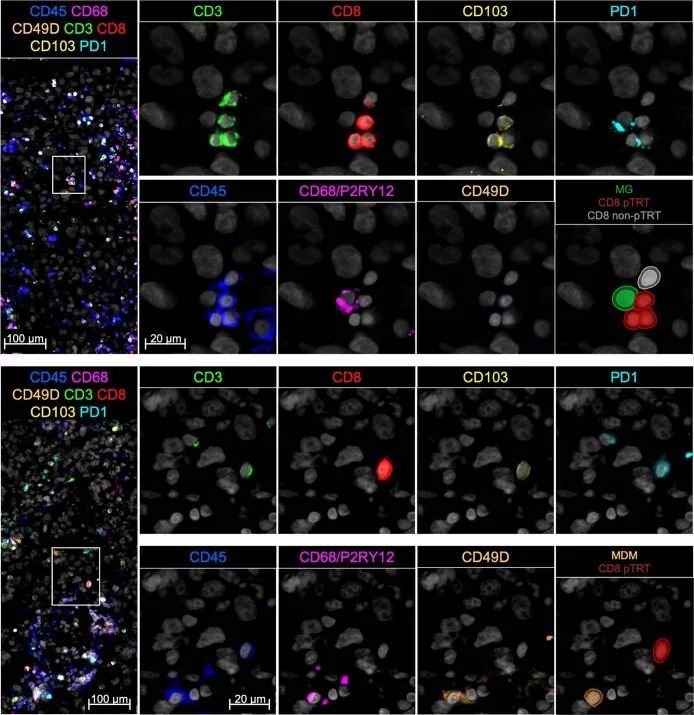
作者接下来检查了在pTRT细胞高和细胞低的肿瘤中,TAM与T细胞之间的通讯潜力是否存在差异。作者分析了来自同一肿瘤样本的分选的MG和MDM的转录组,同时作者也收集了T细胞(扩展数据图6a、b)。使用Hallmark和Gene Ontology生物过程基因集进行GSEA分析,发现MG和MDM之间存在显著差异(图5c和附表3a)。特别是,与干扰素反应和抗原呈递相关的基因集在从pTRT细胞高的BrM中分离的TAM群体中富集程度较高,相比于pTRT细胞低的BrM和胶质瘤样本(图5c)。此外,TAM中抗原呈递基因的富集程度与CD8 T细胞中pTRT细胞特征基因的富集程度之间存在强相关(图5d)。差异表达分析确认了干扰素反应和抗原呈递基因的上调,并且还揭示了pTRT细胞高的BrM中TAM中T细胞招募分子CXCL9、CXCL10和CXCL11的表达显著增加(图5e,扩展数据图)。6b6b和补充表3b)。此外,TAM中T细胞招募趋化因子的表达水平与同一样本中CD8 + T细胞的丰度显著相关(图5f)。值得注意的是,除了招募和激活T细胞的能力外,来自pTRT细胞高表达的BrM的TAM还表达了高水平的IDO1,这表明它们可能具有抑制T细胞的特性(扩展数据图6c)。

目前对于脑癌中的pTRT细胞了解甚少,但这些细胞已在几种颅外肿瘤类型中进行了研究。因此,作者接下来比较了颅内和颅外肿瘤中的pTRT细胞。作者首先分析了来自21种不同颅外癌症类型和316名个体的单细胞RNA测序数据,以了解BrM pTRT细胞单细胞RNA测序聚类C3中前十个基因的表达情况。有趣的是,作者发现所有十个基因在CD8.c12.Tex.CXCL13聚类中的表达最高,该聚类已被注释为含有最大比例的pTRT细胞,从而表明颅内和颅外pTRT细胞之间存在相似性(图6a)。

为了进一步扩展这些发现,作者对额外的TILs和从12名胶质瘤患者(8例IDH野生型和4例IDH突变型)、13名脑转移瘤患者(10例非小细胞肺癌,1例黑色素瘤,1例表皮癌和1例肉瘤)、11名原发性乳腺癌患者和33名非小细胞肺癌患者的血液T细胞中进行了高维FCM分析(图6b和附表1a和4)。与前述相同,作者关注CD8 T细胞。在对这些数据进行归一化后,作者进行了无监督聚类,并定义了12个不同的细胞学亚型(CCs),其中几个显示出明显的组织特异性优势(图6c和扩展数据图7a、b)。通过分析单个蛋白质,作者发现了一个pTRT细胞亚型CC9,其表达CD39、CXCL13、TIM3、PD1和CD45RO的水平较高(图6d)。如预期,所有疾病组的血液样本中都缺乏CC9细胞,而在肿瘤中,这些细胞以不同的频率被检测到(图6d、e和扩展数据图7a)。在胶质瘤和原发性乳腺癌肿瘤中,CC9细胞平均占所有CD8 TILs的5%,只有1个乳腺癌肿瘤样本(1/11)显示高CC9含量(图 6e,f)。相比之下,绝大多数原发性非小细胞肺癌(NSCLC)肿瘤显示出高浸润的CC9细胞,平均占肿瘤浸润淋巴细胞(TILs)的25%。在脑转移瘤(BrM)中,作者再次区分出两组个体,一组CC9细胞含量低(7/13),另一组CC9细胞含量高(6/13)(图6f)。在CC9细胞含量高的六个脑转移瘤肿瘤中,包括一个黑色素瘤-脑转移瘤和十个非小细胞肺癌-脑转移瘤。值得注意的是,在CC9细胞比例高(>30%)的原发性非小细胞肺癌和脑转移瘤肿瘤中,这些细胞的含量相似(图6e,f)。总体而言,CC9细胞在疾病组之间的变异性较大(扩展数据图7c)。

总结
总之,这项研究对于脑癌患者的临床管理具有重要意义。CXCL13表达(CD39 + )的CD8 + T细胞的丰度以及肿瘤微环境中CXCL9的表达是许多不同原发癌症类型(包括肺癌和三阴性乳腺癌)对免疫检查点抑制剂(ICB)反应的强有力预测因子。这些因素也可能表明脑部对ICB的敏感性,作者发现这两个因素在pTRT细胞高表达的脑转移瘤中显著富集。此外,pTRT细胞高表达的脑转移瘤中CXCL13 + CD39 + CD8 + TILs的比例与原发非小细胞肺癌(ICB反应最好的癌症之一)相似。这表明只有pTRT细胞高表达的肿瘤患者才有可能从这种治疗中获益,而pTRT细胞低表达的肿瘤患者则不会。虽然如何在不进行手术切除的情况下评估脑肿瘤的pTRT细胞状态仍然是一个悬而未决的问题,但作者的数据提供了加强研究脑肿瘤中T细胞数量和质量的最小侵入性程序的理由。
