
导语
今天给同学们分享一篇生信文章“CD8+ tissue-resident memory T cells induce oral lichen planus erosion via cytokine network”,这篇文章发表在Elife期刊上,影响因子为7.7。

结果解读:
单细胞RNA测序揭示了具有不同临床亚型的OLP的细胞组成为了研究口腔扁平苔藓(OLP)的细胞组成和全面的转录效应,作者对NEOLP(NEOLP,n = 3)和EOLP(EOLP,n = 2)进行了单细胞RNA测序(scRNA-seq)。最终的数据集包括46,377个细胞,每个细胞平均含有1743个基因。使用统一流形逼近和投影(UMAP)进行可视化,发现了47个不同的细胞亚型(图1A),并将其注释为8个主要细胞类型(图1B)。尽管NEOLP和EOLP之间的T细胞比例没有显著差异,但T细胞仍然是EOLP中的主要细胞比例。令人惊讶的是,尽管T细胞是OLP的标志性细胞,但在EOLP-2中的细胞比例最低,为47.47%,而NEOLP-3病例中的T细胞比例最高,为71.93%。细胞组成分析还显示EOLP中B细胞和髓系细胞的比例增加(图1C,D)。作者对髓系细胞的分析发现了一些有趣的发现。作者观察到中性粒细胞在EOLP中明显更丰富于NEOLP(图1—附图1A,B)。同样地,与非早期口腔扁平苔藓(NEOLP)相比,浆细胞样细胞(pDC)在晚期口腔扁平苔藓(EOLP)中也更常见。然而,NEOLP中的髓样细胞(mDC)数量较EOLP更高(图1—附图1A–D)。进行GO分析后,作者发现EOLP中的中性粒细胞在防御反应和细胞因子产生的正调控方面显著富集(图1—附图1E)。


OLP的典型病理表现是T细胞在上皮下层的带状浸润。目前,大多数观点认为OLP是由T细胞介导的免疫相关性疾病。因此,作者接下来进一步分析了T细胞群体。
由于NK细胞和T细胞也是来源于淋巴样祖细胞,因此NK细胞和T细胞在发育上更为接近,成熟的NK细胞在激活后会表达CD3(T细胞的特征基因),而成熟的NK细胞的细胞毒性反应与CTL类似(Abel等,2018)。因此,在最初的研究中,将T细胞和NK细胞一起纳入,形成单独的NK细胞和T细胞群体,而NK/T群体在研究数据中占据了大部分被测序的细胞。随后,通过进一步聚类,将NK/T细胞群体的基因分为了总共23个细胞亚群(图2—附图1A、B)。在进一步使用标记基因对NK/T细胞亚群进行注释后,描述了六个大的细胞亚群:NK细胞、CD8 T细胞、CD4 T细胞、CD4 CD8 T细胞、CD8 Trm细胞和CD4 CD8 Trm细胞(图2A、B)。
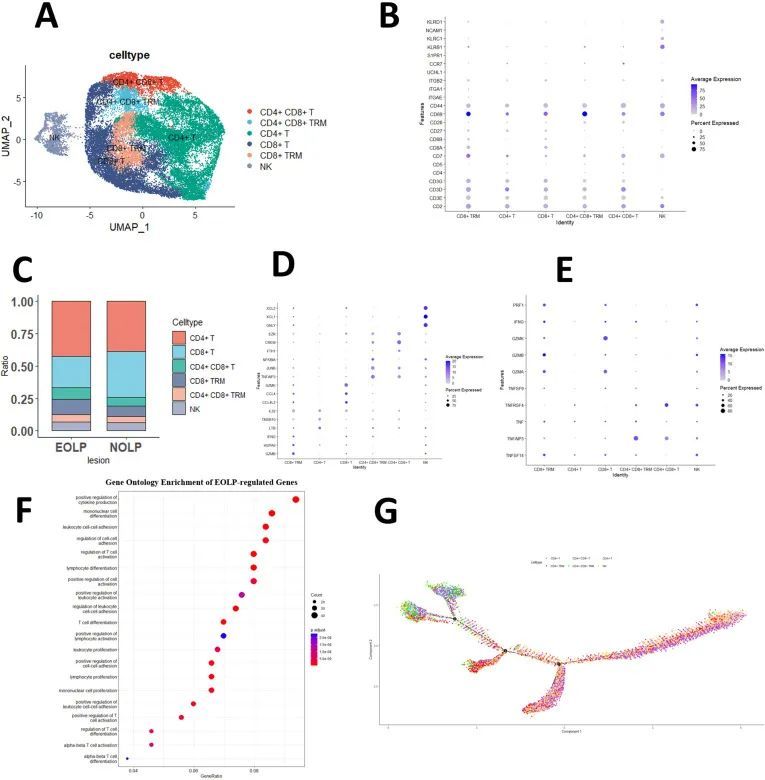


为了进一步探索T细胞的功能,本研究表明,在CD4 T细胞亚群中,炎症反应基因LTB显著活跃,而引导免疫细胞迁移到炎症部位的CCL4、CCL4L2和CLL5在CD8 Trm和CD8 T细胞亚群中被激活,后者的表达更为明显;抑制细胞增殖的基因BTG1在CD4 CD8 T和CD4 CD8 TRM亚群中显著表达(图2D和图2—附图1C)。
作者的研究还探讨了不同T细胞亚群产生促炎细胞因子的情况。作者观察到CD8 T细胞亚群相比其他亚群,GZMK基因的表达显著增加,该基因已知对靶细胞的细胞毒性和诱导凋亡起到贡献作用。此外,特别是CD8 Trm细胞相比其他亚群,GZMA、GZMK、TNF、PRF1等与炎症因子相关的基因表达水平更高。这可能导致了OLP临床表现的恶化(图2E)。
进一步分析NEOLP和EOLP之间显著不同的基因表达,发现与MHC I类分子稳定性和抗原呈递密切相关的B2M以及调节免疫细胞功能和炎症的HIF1A在EOLP中显著表达。此外,EOLP还表达了一些与Trm细胞分化和功能相关的标记物,包括CD69、IL7R、CD7、FOS等(图2—附图2A,附表1a)。
为了研究EOLP和NEOLP中CD8 Trm细胞的差异,作者进行了差异表达分析,并发现在EOLP中CD8 Trm亚群中,CD69、GNLY(可以发挥细胞毒性作用)以及多个与促炎因子相关的基因,如GZMB、IFNG、TNF和PRF1,显著增加。这些发现表明,与NEOLP相比,EOLP中CD8 Trm的活性可能显著增强(图2—附图2B,附表1b)。
GO富集分析表明,EOLP中CD8 Trm差异表达基因(DEGs)与NEOLP相比,在正调节细胞因子产生、T细胞活化调节和细胞活化正调节等途径中富集显著(图2F)。这表明,EOLP中CD8 Trm亚群与NEOLP亚群相比,具有不同的状态和表达,并且可能具有更活跃的状态和更强的细胞因子产生能力。伪时分析还表明,CD8 Trm细胞可能代表OLP中T细胞分化和发育的终末状态之一(图2G),这可能与其临床表现有着深刻的关系。
空间转录组学揭示CD8 Trm细胞紧邻口腔扁平苔藓的上皮,并且其产物可能诱导上皮侵蚀并促进疾病的发展细胞类型、细胞之间的相对位置以及细胞群体的基因表达水平共同决定了生物组织中它们的功能。为了研究正常口腔黏膜和口腔扁平苔藓(OLP)之间的空间异质性,作者对正常口腔黏膜(n = 2)、非增生性OLP(n = 3)和增生性OLP(n = 1)进行了空间转录组学(ST)分析。
该研究中的组织覆盖范围从NEOLP-1的最低296个点到NEOLP-3的最高965个点,而每个样本的捕获因子范围为2869至3884。首先,作者使用角蛋白来表征上皮的基底层。正常口腔黏膜和NEOLP具有完整的上皮,而一些NEOLP样本显示出萎缩和变薄的上皮,而其他样本则显示出增生和增厚。在EOLP中,可以看到组织左侧的上皮完整,而右侧的上皮缺失(图3A)。

为了客观地阐明口腔扁平苔藓(OLP)侵蚀的分子机制,作者建立了一个由40名参与者组成的临床队列,这些参与者经过临床表现和病理诊断确认。临床队列的基本信息如表1所示。本研究包括40名OLP患者,其中NEOLP组有15名女性和12名男性,EOLP组有8名女性和5名男性。NEOLP组的平均年龄为30.07 ± 11.34岁,EOLP组的平均年龄为45.08 ± 12.86岁。NEOLP组有7名吸烟患者和9名饮酒患者,EOLP组有2名吸烟患者和3名饮酒患者。NEOLP组的VAS评分平均为1.41 ± 0.89,EOLP组的VAS评分平均为2.46 ± 1.391。NEOLP组的病程平均为14.85 ± 27.932个月,EOLP组的病程平均为14.85 ± 27.932个月。两组临床信息之间没有显著差异。
通过差异基因分析发现,在NEOLP和EOLP中,CD8 Trm细胞的多个核心因子和效应细胞因子或其受体转录因子的表达,包括ITGA1、LITAF、SKIL等,以及与之相关的免疫因子受体如TNFRSF6B、IL17RA和IFNAR1,在EOLP中显著增加,而在NEOLP中较低(图4A、B)。
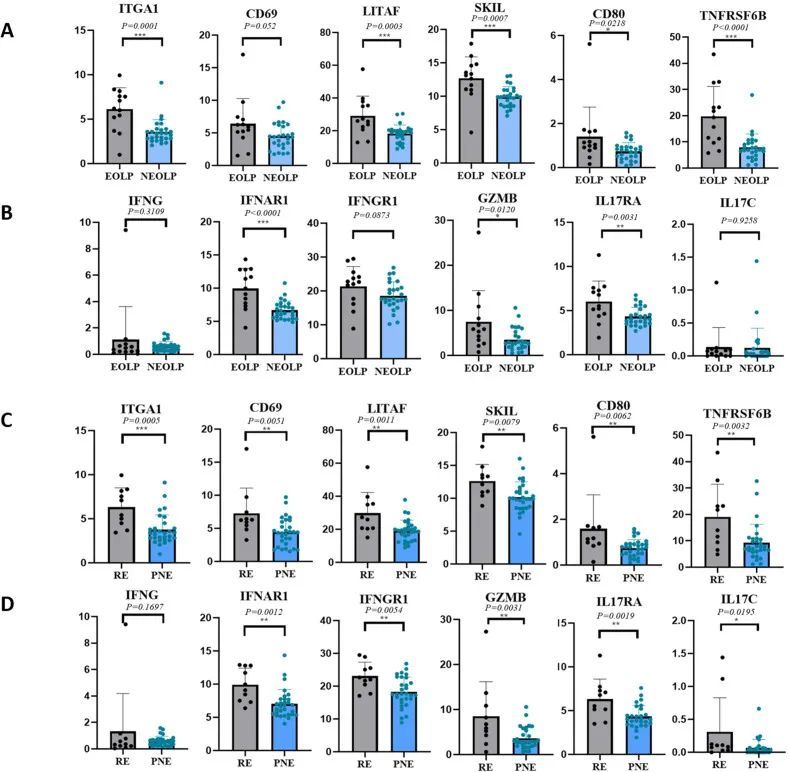
免疫荧光实验证实NEOLP和EOLP中存在CD8 Trm细胞。EOLP中的CD8 Trm细胞含量明显高于NEOLP。从位置上可以看出,CD8 Trm细胞大多靠近基底层。在NEOLP中,基底膜基本完整,零星的T细胞进入上皮层,而在EOLP中,CD8 Trm细胞明显积聚在糜烂的上皮下,数量明显高于NEOLP,并且在某些地方黏膜上皮基底膜不清晰,更多的T细胞进入黏膜上皮层,其中一些是CD8 Trm细胞(图5A-D)。

总结
作者的研究有两个限制。首先,作者没有对正常口腔黏膜组织进行单细胞RNA测序,以探索CD8 Trm细胞在口腔扁平苔藓发病机制中的作用。其次,由于目前没有口腔扁平苔藓的动物模型,涉及CD8 Trm细胞的细胞共培养模型可以在进一步研究中提供更多证据。尽管存在这些限制,作者的发现支持CD8 Trm细胞在口腔扁平苔藓的疾病过程中起到了重要作用,并且是其临床表现恶化的关键因素。
