导语
今天给同学们分享一篇生信文章“Implications of different cell death patterns for prognosis and immunity in lung adenocarcinoma”,这篇文章发表在NPJ Precis Oncol期刊上,影响因子为7.9。

结果解读:
细胞死亡相关基因与LUAD预后的关系作者调查了与LUAD预后显著相关的基因,然后在图1中分析了与细胞死亡相关的基因的差异表达。多变量分析显示,包括CCT6A(HR = 1.233,95% CI = 0.975–1.560,P = 0.081)、HNRNPF(HR = 1.593,95% CI = 1.115–2.277,P = 0.011)、ID1(HR = 1.117,95% CI = 0.996–1.252,P = 0.058)、IGF2BP1(HR = 1.113,95% CI = 1.005−1.233,P = 0.040)、MYO6(HR = 0.671,95% CI = 0.551−0.817,P = 7.22E−05)、PPP1R3G(HR = 1.586,95% CI = 1.283−1.960,P = 1.97E−05)、TPM2(HR = 1.157,95% CI = 0.980–1.365,P = 0.085)等与坏死程序相关的基因是LUAD预后的独立预测因子。多变量分析的森林图还显示,包括BIRC(HR = 1.138,95% CI = 0.997–1.299,P = 0.055)、FGF2(HR = 1.422,95% CI = 1.146–1.765,P = 0.001)、H2AX(HR = 1.331,95% CI = 1.076−1.647,P = 0.006)、MS4A1(HR = 0.834,95% CI = 0.739−0.941,P = 0.003)、NT5E(HR = 1.144,95% CI = 1.017−1.285,P = 0.024)、PSCA(HR = 1.060,95% CI = 0.993–1.133,P = 0.081)、TLR2(HR = 0.829,95% CI = 0.703−0.977,P = 0.025)其中,FGF2、H2AX、MS4A1、NT5E、TLR2是OS的独立预测因子。此外,其他与LUAD OS相关的细胞死亡类型相关基因的关系在附录1中显示。然后,作者分别基于与LUAD预后显著相关的基因建立了坏死相关风险评分模型和免疫细胞死亡相关风险评分模型。其他细胞死亡类型相关的风险评分也是基于附录2中相同的公式计算的。根据风险评分的最佳截断值,作者将患者分为高风险组和低风险组。高风险组和低风险组之间细胞死亡相关基因的差异表达也在图1中显示。例如,与死亡相关的基因,包括TPM2、PPP1R3G、IGF2BP1、ID1、HNRNPF和CCT6A,以及免疫细胞死亡相关的基因,包括PSCA、NT5E、H2AX、FGF2和BIRC3,在高风险组中表达显著,表明这些基因在癌症的发展和进展中可能起着关键作用。

根据图2a、b,计算并比较了15种细胞死亡特征的1年、2年、3年、4年和5年AUC值。为了探索具有最高AUC值的细胞死亡相关特征的组合,作者评估了一系列由不同细胞死亡类型组成的候选广义线性模型(GLM)。结果发现,坏死程序性细胞死亡+免疫细胞死亡特征,即细胞死亡指数(CDI)特征,具有更高的预测性能。1年、2年、3年、4年和5年的AUC值分别为0.772、0.736、0.723、0.795和0.743(图2b、d)。ROC曲线也支持了上述结论,即CDI特征的1年AUC值(0.772)高于图2c中的坏死程序性细胞死亡或免疫细胞死亡特征(分别为0.764和0.742)。基于CDI、坏死程序性细胞死亡和免疫细胞死亡水平,作者将LUAD患者分为高风险组和低风险组。使用log-rank检验进一步证明了高风险组和低风险组在LUAD生存方面的差异。结果显示,低风险的LUAD患者的总体生存期明显长于高风险组(P < 0)。05) 根据 Kaplan-Meier 生存曲线(图2e-g),统一流形逼近和投影(UMAP)还揭示了基因在高风险和低风险组之间的分类(图2h-j)。在基因相互作用网络中,CDI 签名与与坏死样细胞死亡和免疫细胞死亡相关的基因密切相关,尤其是 HNRNPF、PPP1R3G、IGF2BP1、TLR2、NT5E、BIRC3、PSCA、FGF2、MS4A1、CCT6A、ID1、TPM2(图2k)。如图2l所示,随着 CDI 的增加,LUAD 患者的生存率降低。
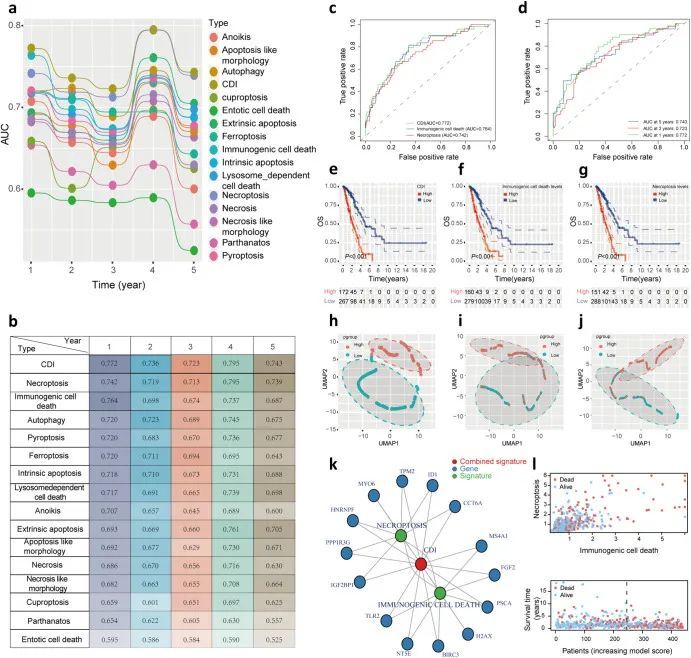
为了研究CDI标志与临床变量的相互作用,作者进行了单变量和多变量Cox回归分析,并得出结论,CDI和N分期是LUAD患者OS的独立预后因素(图3a,b)。通过结合包括CDI和N分期在内的临床因素,建立了一个新的预后模型,用于预测LUAD患者的生存情况并指导临床决策(图3c)。如图3d所示,在训练集中,预后模型、CDI和N分期的1年AUC值分别为0.774、0.772和0.636,显示了预后模型的优越预测性能。从图3e、f中作者可以得出类似的结论。

在以TCGA LUAD队列为基础的CDI签名中,与作者的CDI签名进行比较的选择了包括Necroptosis签名、ICD签名、Pyroptosis签名和Ferroptosis签名在内的先前研究中的四个签名。作者使用相同的方法计算每个签名的风险评分,以便进行比较。这四个签名在1年、3年和5年的AUC值分别在图4a中呈现。显然,作者的CDI签名在1-5年的AUC值明显高于这四个已发表的签名(图4c)。与其他四个签名相比,作者的CDI签名的C-index最高(图4d)。如图4b所示,四个签名的K-M曲线中,作者的签名在高风险组和低风险组之间的预后差异最显著。此外,五个签名的风险比和p值在图4e中绘制。结果显示,与先前的模型相比,作者的CDI签名在预后预测中表现出更好的性能。

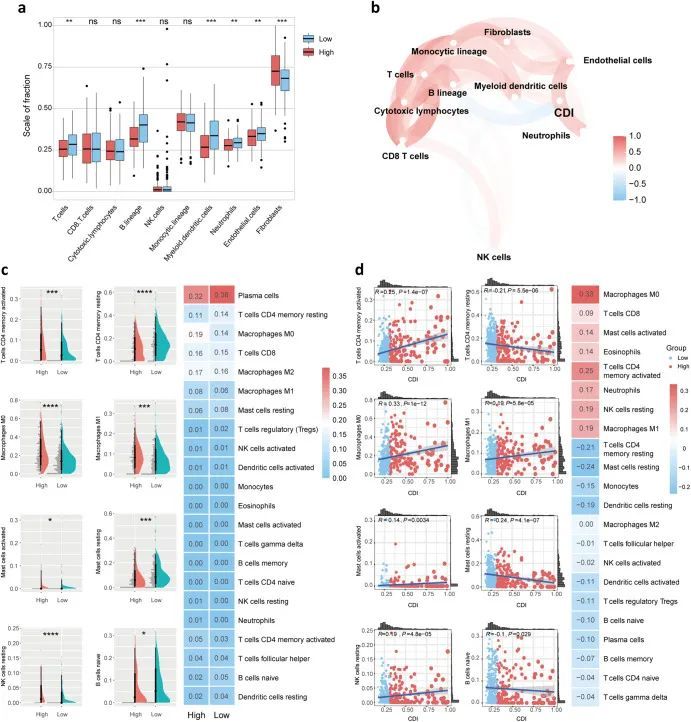
进行了低CDI组和高CDI组免疫细胞浸润的比较,以揭示CDI与LUAD预后强相关的机制。使用MCP计数器比较了高CDI组和低CDI组中8种免疫细胞和2种基质细胞的浸润水平(图5a)。T细胞、B细胞系谱、髓样树突状细胞、中性粒细胞和内皮细胞的绝对丰度评分在低CDI组中统计上更高,而成纤维细胞的评分在高CDI组中更高。使用MCP计数器在图5b中还将CDI标志与免疫细胞群体和基质细胞群体相关联。此外,作者使用CIBERSORT算法检查了高CDI组和低CDI组在免疫细胞浸润方面的差异(图5c)。结果显示,低CDI组主要富集了肥大静止细胞、幼稚B细胞和CD4记忆静止T细胞。相反,高CDI组中明显富集了巨噬细胞M0和M1、CD4记忆活化T细胞和NK静止细胞。此外,使用CIBERSORT算法探索了CDI标记在22种免疫细胞浸润中的作用。CD4 + 记忆激活T细胞、巨噬细胞M0和M1、活化肥大细胞以及静息NK细胞的浸润水平与CDI呈正相关,而CD4记忆静息T细胞、静息肥大细胞和幼稚B细胞的浸润水平与CDI呈负相关(图(图5d5d)。
通过使用包括CIBERSORT、EPIC、QUANTISEQ、TIMER和XCELL在内的多个算法,作者对低CDI组和高CDI组的免疫景观提供了深入的洞察,以避免单一算法引起的不准确和偏见。如图6a所示,根据CIBERSORT、EPIC、QUANTISEQ、TIMER和XCELL的结果,CDI与免疫细胞浸润水平相关。通过使用上述算法,作者能够比较图6b中高CDI组和低CDI组的免疫细胞浸润水平。例如,无论使用哪种算法,低CDI组的B细胞浸润水平显著较高。然后,作者应用ESTIMATE算法比较了图6c至f中高CDI组和低CDI组的ESTIMATE评分、免疫评分、基质评分和肿瘤纯度。低CDI组的免疫评分较高,并且免疫评分与CDI之间存在显著的负相关关系(P < 0.05)(图6g至j)。

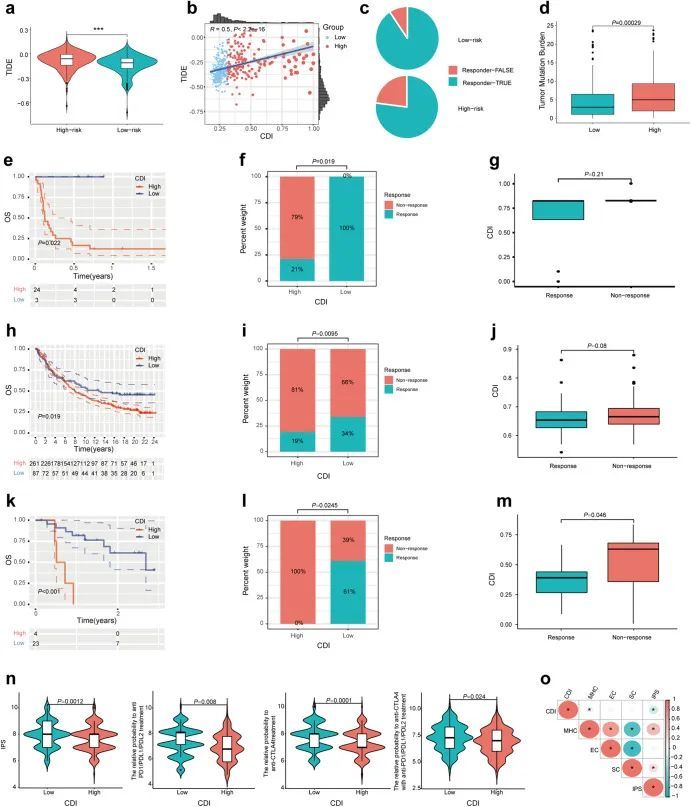
在现代,以ICIs为代表的癌症免疫治疗是复发和转移性LUAD的一种有希望的治疗选择。TIDE评分与肿瘤微环境中的免疫逃逸和免疫治疗抵抗密切相关。较高的TIDE评分表示较高的免疫逃逸潜力和较低的免疫治疗反应率。根据图7a、b,低CDI组的TIDE评分显著低于高CDI组,CDI与TIDE评分呈正相关(R = 0.5,P < 2.2e−16),表明低CDI组的免疫治疗反应率较高。此外,作者计算了高CDI组和低CDI组对免疫治疗的响应和非响应患者的百分比(图7c)。由于增加的TMB有助于更强的抗肿瘤免疫反应,作者计算了每个患者的TMB,并在图7d中比较了高CDI组和低CDI组之间的差异。结果发现,低CDI组的TMB低于高CDI组。随后,作者在接受免疫治疗的LUAD患者的GSE135222中研究了预后与CDI标记之间的关系 31,32 。根据Kaplan-Meier生存曲线,低CDI组的总生存率高于高CDI组(P = 0.022)(图(图7e))。在接受免疫治疗的LUAD患者中,比较了高CDI组和低CDI组的反应者和非反应者的比例,以及图7f、g中免疫治疗反应者和非反应者之间的CDI差异。低CDI组的反应率显著较高(P = 0.019),尽管反应患者和非反应患者之间的CDI值没有显著差异(P = 0.21)。在接受免疫治疗的转移性尿路上皮癌(MuC)患者(来自iMvigor210队列)和黑色素瘤患者(来自GSE78220队列)中也观察到类似的结果(图7h-m)。如图图7n所示,低CDI组的免疫表型评分(IPS)相对概率以及包括抗PD1/PDL1/PDL2、抗CTLA4和两种治疗方法的免疫检查点抑制剂较高(P < 0.05)。此外,作者还探讨了CDI与免疫治疗相关的生物标志物之间的相关性,如MHC分子、效应细胞(EC)、免疫检查点和抑制细胞(SC)。MHC和EC促进了抗肿瘤免疫反应,而免疫检查点和SC抑制了免疫反应。类似的结果也在图7o7o中观察到,CDI与IPS和MHC的表达呈负相关,与EC和SC的表达呈正相关,尽管没有显著性差异。
总结
总之,本研究建立的CDI标志是一种新的预后预测因子,揭示了LUAD诊断、预后评估和个体化治疗的新免疫治疗靶点和理论基础。对这篇文章的思路感兴趣的老师,欢迎咨询!
生信分析定制服务
